各项目负责人:
为保障我院科研工作安全、有序开展,保证临床试验研究的伦理规范性,降低科研中的不确定性和潜在风险,我院医学伦理委员将长期受理临床科研项目、临床试验、新技术新项目的伦理审查申请。根据《涉及人的生命科学和医学研究伦理审查办法》国卫科教发〔2023〕4号、《涉及人的生物医学研究伦理审查办法》国卫科教发〔2016〕11号的文件要求:涉及人的生物医学研究项目“未获得伦理委员会审查批准的,不得开展项目研究工作”。请各位申请人及时提交伦理审查材料至伦理审查系统,医学伦理委员会将根据每个项目的具体内容和提交时间,确定审查方式和会议审查时间。未按要求进行伦理审查及经审查存在违反伦理道德的研究活动禁止在我院临床开展,现将具体要求通知如下:
一、审查范围:
1. 国家级、省部级、厅局级、校级和院级立项的临床科研项目;
2. 药物、医疗器械和体外诊断试剂临床试验项目;
3. 自拟临床研究课题;请先将临床研究方案{清单(1)- 3}提交至科研部邮箱zskjk08@163.com申报备案,收到科研部审核通过的邮件后,再使用伦理审查系统提交相关材料。
4. 新技术新项目;
二、形式和要求
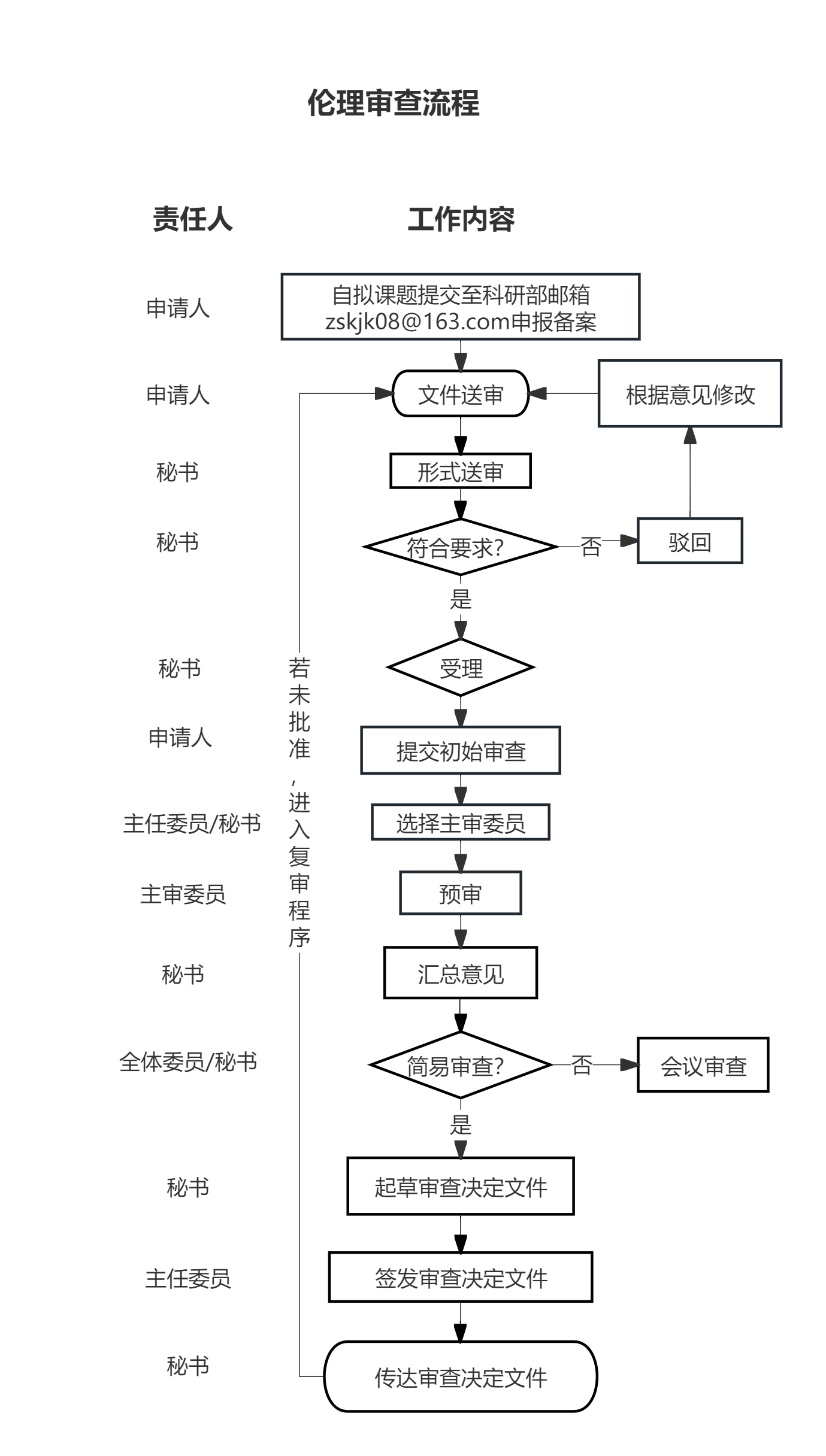
申请人按照材料清单填写及撰写后,请使用伦理审查系统(https://zjszsyy.trialos.com/login/)递交材料,伦理系统的使用方法详见附件9。纸质稿暂不上交,待通过形式审查后另行通知。
三、上交材料清单
(1)临床科研项目、临床试验项目、自拟临床研究课题
1. 伦理审查申请(下载链接:初始审查申请表)
2. 主要研究者专业履历(下载链接:主要研究者履历表)
3. 临床研究方案(下载链接:研究方案模板,参考模板,注明版本号/版本日期)
4. 知情同意书(下载链接:知情同意书模板,参考模板,可根据研究要求自行设计,注明版本号/版本日期)
如无知情同意书,请填写“免除知情同意申请”(下载链接:免除知情同意申请)
5. 招募受试者材料(指招募广告、宣传册等等,如有,请提供)
6. 病例报告表(下载链接:病例报告表模板,根据研究要求自行设计)
(2)新技术新项目
1. 新技术新项目伦理审查申请(下载链接:新技术新项目申请表)
2. 临床研究方案(下载链接:技术方案,参考模板,注明版本号/版本日期)
3. 知情同意书(下载链接:知情同意书模板,可根据研究要求自行设计,注明版本号/版本日期)
4. 相关人员履历(下载链接:相关人员履历表)
(3)获得批件后的跟踪审查
1. 复审申请表(下载链接:复审申请表)
2. 修正案申请(下载链接:修正案申请表)
3. 研究进展报告(下载链接:研究进展报告)
4. 严重不良事件报告(下载链接:严重不良事件报告表)
5. 违背方案报告(下载链接:违背方案报告表)
6. 暂停研究报告(下载链接:暂停研究报告表)
7. 研究完成报告(下载链接:研究完成报告表)
8. 免除伦理审查申请(下载链接:免除审查申请表)
9. 伦理系统的使用方法(下载链接:伦理系统的使用方法)
四、联系人及方式
联系人:燕晴 吴媛媛
联系电话:0571-88393504
医学伦理委员会邮箱:zslunli@163.com